В 1787 г. Шарль показал, что при постоянном давлении объем газа изменяется  пропорционально его температуре. Эта зависимость представлена в графической форме на рис. 3.3, из которого видно, что объем газа линейно связан с его температурой. В математической форме эта зависимость выражается так:
пропорционально его температуре. Эта зависимость представлена в графической форме на рис. 3.3, из которого видно, что объем газа линейно связан с его температурой. В математической форме эта зависимость выражается так:


Рис. 3.2. Графические формы представления закона Бойля-Мариотта.

Рис. 3.3. Закон Гей-Люссака (Шарля).
где Т — абсолютная температура. Однако закон Шарля чаще записывают в другом виде:

Закон Шарля усовершенствовал Ж. Гей-Люссак, который в 1802 г. установил, что объем газа при изменении его температуры на 1°С изменяется на 1/273 часть того объема, который он занимал при 0°С. Отсюда следует, что если взять произвольный объем любого газа при 0°С и при постоянном давлении уменьшить его температуру на 273°С, то конечный объем окажется равным нулю. Это соответствует температуре -273°С, или 0 К. Такая температура называется абсолютным нулем. В действительности ее нельзя достичь. На рис. 3.3 показано, как экстраполяция графиков зависимости объема газа от температуры приводит к нулевому объему при 0 К.
Абсолютный нуль, строго говоря, недостижим. Однако в лабораторных условиях удается достичь температур, отличающихся от абсолютного нуля всего на 0,001 К. При таких температурах беспорядочные движения молекул практически прекращаются. Это приводит к появлению удивительных свойств. Например, металлы, охлажденные до температур, близких к абсолютному нулю, почти полностью утрачивают электрическое сопротивление и становятся сверхпроводящими. Примером веществ с другими необычными низкотемпературными свойствами является гелий. При температурах, близких к абсолютному нулю, у гелия исчезает вязкость и он становится сверхтекучим.
edu.sernam.ru
Закон гейлюсака это





§ 10. Закон Гей-Люссака
Французский физик Гей-Люссак открыл закон (в 1802 г.), который выражает зависимость изменения объема газа от изменения его температуры при постоянном давлении.
Опыты показывают, что при нагревании вещество расширяется. Скалярная величина, измеряемая изменением единицы объема вещества, взятого при 0° С, от изменения его температуры на 1° С, называется коэффициентом объемного расширения β. Если V0 — объем газа при 0°С, V — после нагревания на t°, V — V0 — изменение всего первоначального объема, то изменение единицы первоначального объема 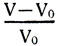 при нагревании на 1° и будет коэффициентом объемного расширения
при нагревании на 1° и будет коэффициентом объемного расширения 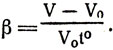
Определив коэффициенты объемного расширения для различных газов, Гей-Люссак открыл, что при постоянном давлении все газы имеют один и тот же коэффициент объемного расширения 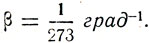 Все газы расширяются одинаково. Из формулы коэффициента объемного расширения
Все газы расширяются одинаково. Из формулы коэффициента объемного расширения
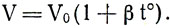
Заменим t° = T-273°. Получим
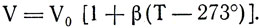
Заменив 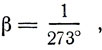 получим
получим
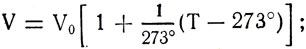
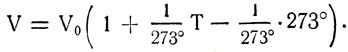
Если объем газа при температуре T1 обозначить V1, а при температуре Т2 — V2, то V1 = βV0Т1 и V2 = βV0Т2. Сравнив объемы, получим формулу закона Гей-Люссака:
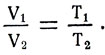
Для одной массы газа при постоянном давлении объем газа изменяется прямо пропорционально изменению абсолютной температуры газа. Это и есть формулировка закона Гей-Люссака. Процесс изменения состояния газа при постоянном давлении называется изобарическим (рис. 12). Формула, выражающая закон Гей-Люссака, является уравнением изобарического состояния газа.
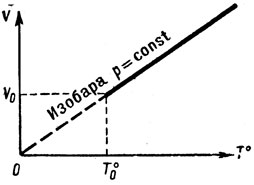
Рис. 12. График изобарического процесса
По закону Гей-Люссака производят расчет изменения объема газа в газгольдере (резервуар для хранения газа) с изменением температуры атмосферного воздуха; объема газа в период горения горючей смеси в цилиндре двигателя.
Задача 2. Для наблюдения расширения воздуха при нагревании колбу емкостью 0,5 л, опущенную горлышком в воду, нагрели до 47° С. После остывания воздуха в колбе до 17° С в нее зашла вода. Насколько уменьшился объем воздуха в колбе? Какова масса воды, вошедшей в колбу? Процесс изобарический. (Изменением давления воздуха в колбе пренебрегаем.)

Масса вошедшей воды m = ρΔV, m = 1000 кг /м 3 *0,00005 м 3 = 0,05 кг.
physiclib.ru
Изопроцессы в газах. Закон Гей-Люссака.
При постоянном давлении р объем V идеального газа меняется линейно с температурой.

где V0 — начальный объем, t — разность начальной и конечной температур. Коэффициент теплового расширения идеальных газов α = (1/273,15)К -1 одинаков для всех газов.
Процесс изменения состояния термодинамической системы при постоянном давлении называется изобарным (от греч. baros — вес, тяжесть).
Закон открыт французским ученым Ж. Гей-Люссаком в 1802 г. и независимо от него Дж. Дальтоном в 1801 г.
Закон Гей-Люссака, как и другие газовые законы, является следствием уравнения состояния идеального газа. Это становится очевидным, если в  заменить t на абсолютную температуру Т= t + 273,15, а коэффициент расширения α — его численным значением 1/273,15:
заменить t на абсолютную температуру Т= t + 273,15, а коэффициент расширения α — его численным значением 1/273,15:
 ,
,

Для газа данной массы отношение объема к температуре постоянно, если давление газа не меняется.
Согласно  , объем газа линейно зависит от температуры при постоянном давлении:
, объем газа линейно зависит от температуры при постоянном давлении:
Эта зависимость графически изображается прямой, которая называется изобарой.

Различным давлениям соответствуют разные изобары. С ростом давления объем газа при постоянной температуре, согласно закону Бойля—Мариотта, уменьшается, поэтому изобара, соответствующая более высокому давлению р2, лежит ниже изобары, соответствующей более низкому давлению р1.
В области низких температур все изобары идеального газа сходятся в точке Т = 0, но это не означает, что объем реального газа действительно обращается в нуль. При низких температурах все газы обращаются в жидкости, а к жидкостям уравнение состояния не применимо.
www.calc.ru
Закон Гей-Люссака. Изобара
Открытие газового закона Р. Бойлем и Э. Мариоттом для изотермических процессов побудило ученых искать другие функциональные зависимости макропараметров газов. В 1802 году французский ученый Ж. Л. Гей-Люссак, исследуя зависимость объема газа от температуры при постоянном давлении, установил закон, названный со временем в его честь.

Жозеф Луи Гей-Люссак (1778—1850) — французский физик и химик, установил, что коэффициент расширения всех газов одинаковый; исследовал температуру и влажность воздуха на высоте до 7 км, дважды поднимаясь в 1804 г. на воздушном шаре. Изобрел спиртометр, барометр и ряд других приборов.
Стеклянную трубку с резервуаром, в котором был исследуемый газ, он помещал в нагреватель. Газ «закупоривался» маленькой капелькой ртути в трубке, размещенной горизонтально (рис. 1.8). Таким образом, давление газа в резервуаре всегда равнялось атмосферному. Температура газа в резервуаре с помощью нагревателя изменялась от 0 до 100°С. Изменение объема газа от V0 (при t0 = 0) до V при неизменном давлении фиксировалось благодаря перемещению капельки ртути.

Обобщив экспериментальные данные, Гей-Люссак установил, что с изменением температуры при постоянном давлении относительный объем данной массы газа изменяется линейно.
На основании наблюдений он сформулировал утверждение, названное в его честь законом Гей-Люссака.
Закон Гей-Люссака. При постоянном давлении относительное изменение объема газа данной массы прямо пропорционально изменению температуры:
где Δt — изменение температуры; V — объем газа при определенной температуре t.
После некоторых математических преобразований, закон Гей-Люссака можно записать также в виде:
worldofschool.ru
ЗАКОН ШАРЛЯ
Научно-технический энциклопедический словарь .
Смотреть что такое «ЗАКОН ШАРЛЯ» в других словарях:
ЗАКОН ШАРЛЯ — один из основных газовых законов, согласно которому давление р данной массы идеального газа при постоянном объёме изменяется пропорционально изменению термодинамической (абсолютной) температуры Т: Реальные газы подчиняются этому закону при… … Большая политехническая энциклопедия
Закон Шарля — или второй закон Гей Люссака один из основных газовых законов, описывающий соотношение давления и температуры для идеального газа. Экспериментальным путем зависимость давления газа от температуры при постоянном объёме установлена в 1787 году… … Википедия
закон Шарля — Šarlio dėsnis statusas T sritis fizika atitikmenys: angl. Charles’ law vok. Charlessches Gesetz, n rus. закон Шарля, m pranc. loi de Charles, f … Fizikos terminų žodynas
Закон Бойля-Мариотта — Закон Бойля Мариотта один из основных газовых законов. Закон назван в честь ирландского физика, химика и философа Роберта Бойля (1627 1691), открывшего его в 1662, а также в честь французского физика Эдма Мариотта (1620 1684), который открыл… … Википедия
Закон Бойля — Мариотта — Воздух (или инертный газ), находящийся в запечатанном пакете с печеньем расширяется, когда продукт поднят на значительную высоту над уровнем моря (ок 2000 м) Закон Бойля Мариотта один из основных газовых з … Википедия
ЗАКОН ИДЕАЛЬНОГО ГАЗА — ЗАКОН ИДЕАЛЬНОГО ГАЗА, закон, определяющий соотношение давления, температуры и объема идеального газа: pV = nRT, где п количество молекул газа, a R универсальная ГАЗОВАЯ ПОСТОЯННАЯ; закон гласит, что при постоянной температуре (Т) произведение… … Научно-технический энциклопедический словарь
Закон Гей-Люссака — Анимация, представляющая зависимость объёма газа от температуры (закон Гей Люссака) Закон … Википедия
Шарля закон — давление pt идеального газа неизменной массы и объёма возрастает при нагревании линейно: рt = р0(1 + αt), где рt и р0 давление газа при температурах t и 0°C, α = 1/273К 1. Открыт в 1787 французским учёным Ж. Шарлем, уточнён Ж. Гей Люссаком… … Энциклопедический словарь
Закон Менделеева-Клапейрона — Уравнение состояния Статья является частью серии «Термодинамика». Уравнение состояния идеального газа Уравнение Ван дер Ваальса Уравнение Дитеричи Разделы термодинамики Начала термодинамики Уравнен … Википедия
Закон Бойля — Воздух (или ин … Википедия
dic.academic.ru