Урок–практикум по решению задач в 9-м классе по теме «Решение задач на законы электролиза»
Разделы: Химия
Идея урока: Развитие принципов политехнизации.
Девиз: «Чтобы познать, нужно научиться наблюдать!»
Цели:
- Образовательные: использовать свои знания для решения задач.
- Воспитательные: расширить кругозор учащихся и повысить познавательный интерес к изучению химии и физики; способствовать осознанию материального единства явлений;
- Развивающие: развивать логическое мышление учащихся посредством анализа, сравнения, обобщения изучаемого материала;
- Компьютеры;
- Мультимедиа-проектор;
- Экран.
- Обучающая компьютерная презентация
- слайды «Модель электролиза расплава и растворов солей».
- Видеофрагмент «Электролиз». 1CD Химия 8-11кл. Кирилл и Мефодий,2003г.
- 1С. Образовательная коллекция.SPLINT/Самоучитель. Химия для всех-XXI. Решение задач
- Инструктивная карта по работе с обучающей программой ;
- Карточки по составлению ОВР электролиза.
Использование новых информационных технологий:
Раздаточный материал:
— Индивидуальная, групповая работа: установка связи с предшествующей темой химии: электролиз;
— Фронтальный опрос: по вопросам физики: эл. ток, проводимость;
— Работа с опорными медиатаблицами,
Работа с учебником
I. Этап мотивации и актуализации знаний.
Организационный момент: Постановка цели урока.
Индивидуальная работа:ученик, используя медиапоказ рассказывает злектролиз водного раствора хлорида меди(II) на инертных электродах .
Групповая работа. Остальные выполняют задания ЕГЭ В-4 с дополнением:
1.Составить уравнения ОВР данных веществ на электродах.
2.Установите соответствие между формулой вещества и продуктами электролиза его водного раствора на инертных электродах.
б) гидроксид металла, хлор, водород
в) металл, кислород
г) водород, галоген
д) водород, кислород
е) металл, кислота, кислород
(Вывод на экране.)
Совокупность окислительно-восстановительных реакций, которые протекают на электродах в растворах или расплавах электролитов при пропускании через них электрического тока, называют электролизом.
На катоде источника тока происходит процесс передачи электронов катионам из раствора или расплава, поэтому катод является «восстановителем».
На аноде происходит отдача электронов анионами, поэтому анод является «окислителем».
При электролизе, как на аноде, так и на катоде могут происходить конкурирующие процессы.
Правила при составлении электролиза:
1. Процессы на аноде могут образовываться следующие продукты:
а) при электролизе растворов, содержащих в своем составе анионы F + , SO4 2- , NO3 — , PO4 3- , а также растворов щелочей выделяется кислород;
б) при окислении анионов бескислородных кислот Cl — , Br — , I — , выделяются соответственно хлор, бром, йод;
2. Процессы на катоде
а) если ионы металлов, расположены в ряду напряжений левее Al 3+ , выделяется водород;
б)если ион расположен в ряду напряжений правее водорода, то на катоде выделяется металл.
в) При электролизе растворов солей, содержащих ионы, расположенные в ряду напряжений между Al 3+ и H + , на катоде могут протекать конкурирующие процессы как восстановления катионов, так и выделения водорода.
К + , Са 2+ , Na + , Mg 2+ , AL 3+ , Zn 2+ , Fe 2+ , Ni 2+ , Sn 2+ ,Pb 2+ ,H + ,Cu 2+ ,Hg 2+ ,Ag + ,Pt 4+ ,Au 3+ ,
Фронтальный опрос
- В каких состояниях может находиться вещество?
- На какие группы делятся вещества по проводимости электрического тока?
- Какая проводимость в металлах?
- Чем обусловлена собственная проводимость полупроводников?
- Какая проводимость в газах?
- Проводимости каких веществ мы еще не рассматривали?
- Показ на экране анимации или видеофрагмент процесса электролиза.
II. Этап изучение нового материала
Для решения химических задач учащиеся должны быть готовы уметь составлять окончательный процесс уравнения реакции электролиза. Учитель объясняет ход решения задач на экране. Далее учащиеся решают задачу из учебника
При электролизе на катодах происходит выделение вещества. От чего зависит масса вещества, выделяющегося за определенный промежуток времени? Масса вещества, выделившегося на электроде равна:
где moi — масса одного иона,
Ni — число ионов, достигших электродов.
Из курса физики и химии мы уже энаем:
где М — молярная масса, NА — число Авогадро.
Ni = 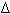 q/qoi, но qoi = n * e ,
q/qoi, но qoi = n * e , 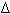 q = I *
q = I * 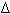 t,
t,
где n — валентность,
е — заряд электрона,
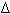 t — время
t — время
Получаем m = M/NA * I 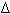 t / n * e , или m = M/NA * n * e * I
t / n * e , или m = M/NA * n * e * I 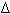 t
t
Если введем постоянную k = M/NA * n * e , то получаем m = k * I 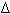 t ,
t ,
где k — электрохимический эквивалент вещества, коэффициент пропорциональности, зависящий от природы вещества.
Вывод: масса вещества, выделившегося на электроде за время 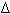 t при прохождении электрического тока, пропорциональна силе тока и времени. Это утверждение, полученное нами теоретически, впервые было установлено экспериментально Фарадеем, носит название закона электролиза Фарадея.
t при прохождении электрического тока, пропорциональна силе тока и времени. Это утверждение, полученное нами теоретически, впервые было установлено экспериментально Фарадеем, носит название закона электролиза Фарадея.
Проецирование на экране: Майкл Фарадей (1711 — 1867) — английский физик, основоположник учения об электрических и магнитных полях. М.Фарадей родился в предместье Лондона в семье кузнеца. Свое образование он получил в начальной школе. В возрасте 13 лет ему пришлось поступить учеником в переплетную мастерскую. Увлекшись чтением книг, особенно по электричеству и химии, Фарадей начинает сам проделывать описанные в них опыты. И в 1813 году (22 года) он был принят на работу в лабораторию известного английского химика Г.Дэви. Так сказал о нем Столетов: «Никогда со времени Галилея свет не видел стольких поразительных и разнообразных открытий, вышедших из одной головы, и едва мы скоро увидим другого Фарадея:»
Учитель: А сейчас решим задачу на данный закон Фарадея.
Задача: При никелировании детали в течении 50 минут сила тока, проходящего через ванну, была равна 2 А. Какова масса, выделившегося вещества на детали, если электрохимический эквивалент никеля k = 3 * 10 -7 кг/Кл?

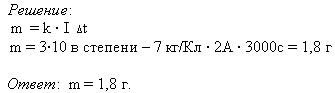
Учитель: Любое научное открытие интересно только тогда, когда находит практическое применение.
Проецирование на экране
1. Электролиз растворов электролитов проводить энергетически выгоднее, чем расплавов, так как электролиты — соли и щелочи — плавятся при очень высоких температурах Электролиз широко используется для получения наиболее активных металлов (щелочных, щелочно-земельных, алюминия, магния), некоторых активных неметаллов (фтор, хлор) и сложных веществ (гидроксида натрия и калия).
2. Для очистки металлов от примесей (рафинирование). Так полученную из руды неочищенную медь отливают в форме толстых листов, которые помещают в ванну в качестве анодов. При электролизе медь анода будет растворяться, примеси выпадают на дно, на катоде, сделанном из особо чистой меди будет оседать чистая медь.Дорого обходится такая рафинированная медь с примесью всего 0,1% и менее, но все затраты покрываются стоимостью извлеченных из нее серебра, золота, селена, теллура.
3. Электролитическим путем покрывают поверхность одного металла тонким слоем другого ( никелем, хромом, оловом, золотом и т.д) для защиты поверхности от коррозии.
4. Если на поверхность металла нанести слой графита, то электролизом можно получить точную копию с рельефной поверхности. Это гальфанопластика, открыт русским ученым Б.Якоби, который в 1836 г применил этот способ для изготовления полых фигур в Исааковском соборе в Санк-Петербурге.
III этап. Операционно- исполнительский .Индивидуальная работа с компьютерной программой по решению задач.1С. Образовательная коллекция.SPLINT/Самоучитель. Химия для всех-XXI. Решение задач: теоретическая химия-10060112,10060128,10061401
Для проверки усвоения знаний по теме выполняется самостоятельная работа или тест.
После окончания работы проверяется выполнение задания и оценивается работа.
1. При электролитической диссоциации в растворе электролита присутствуют:
А) молекулы,
Б) ионы,
В) гидратированные ионы.
2. Какая проводимость наблюдается в жидкостях?
А) электронная,
Б) ионная,
В) электронно-ионная
4. Чем отличается проводимость электролитов от проводимости в металлах?
А) ни чем,
Б) в электролитах ионы, в металлах ионы и электроны,
В) в электролитах — ионы, в металлах — электроны.
5. Каким ученым связано развитие гальванотехники:
А) М.Фарадей,
Б) Б.Якоби,
В) С.Аррениус
6. Задача. При силе тока 1,6 А на катоде выделилась медь массой 0,316 г за 10 минут. Найдите значение k меди.
Ответы: 1 — В, 2 — Б, 3 — В, 4 — Б, 5 — 3,3 * 10 -7 кг/Кл
V. Домашнее задание
VI. Рефлексия, выставление оценок.
Ответьте, пожалуйста на следующие вопросы:
xn--i1abbnckbmcl9fb.xn--p1ai
Решение задач по теме «Электрический ток в жидкостях»
Этот видеоурок доступен по абонементу
У вас уже есть абонемент? Войти

На этом уроке мы рассмотрим решения задач на первый и второй законы Фарадея, а так же задач, связанных не только с законами электролиза, но и с законами механики и молекулярной физики.
Условие задачи: В процессе электролиза под действием тока плотностью 300  на электроде выделился слой меди толщиной 0,03 мм. В течении какого времени протекал этот электролиз?
на электроде выделился слой меди толщиной 0,03 мм. В течении какого времени протекал этот электролиз?
Эта задача прежде всего на первый закон Фарадея. Его и запишем:

Отсюда выразим время, необходимое для такого электролиза:

Данное выражение не содержит величин из условия задачи, поэтому мы, конечно же, не можем его пока что использовать. Распишем неизвестные величины через известные. Начнем с массы:

Плотность меди – табличная величина, которая равна 9 . Объем же слоя меди можно выразить через его толщину и площадь:
. Объем же слоя меди можно выразить через его толщину и площадь:

Силу тока также свяжем с его плотностью. Плотность тока определяется как:


Подставим все выражения в первый закон Фарадея:

Как мы видим, данное выражение не зависит от площади пластины:

Электрохимический эквивалент также является табличной величиной, и для меди он равен 0,3 
 .
.
Подставим численные значения:

Условие задачи: Зная электрохимический эквивалент серебра, определите электрохимический эквивалент золота.
Так как в условии не дано ни одного значения, нам, конечно же, понадобятся табличные значения некоторых величин. А именно: электрохимический эквивалент серебра (раз по условию он дан), валентности золота и серебра, а также молярные массы золота и серебра:




Запишем теперь второй закон Фарадея, как для серебра, так и для золота:


Теперь разделим эти два уравнения одно на другое:

Отсюда электрохимический эквивалент золота равен:

Определение электрохимического эквивалента
Электрохимический эквивалент – очень важный параметр вещества, и его нужно уметь определять, к примеру, при отсутствии табличных данных или же при необходимости их проверки.
Для проведения эксперимента нам необходимо создать экспериментальную установку, которая состоит из кюветы с раствором, источника тока, амперметра, реостата, ключа, часов, весов и нагревателя для обсушки электрода (рис. 1).

Рис. 1. Схема экспериментальной установки
В результате действия полярных молекул воды на растворенные в ней молекулы  образуются пары ионов, которые при замыкании ключа начинают движение к противоположным электродам (рис. 2).
образуются пары ионов, которые при замыкании ключа начинают движение к противоположным электродам (рис. 2).

Рис. 2. Действие установки при замыкании ключа
Выставив на реостате необходимое нам сопротивление и отметив силу тока по амперметру (в течении всего опыта сила тока должна оставаться постоянной), мы должны начать отсчет времени с момента замыкания ключа. Через некоторое время размыкаем ключ и достаем из кюветы катод (именно на него оседали положительные ионы меди), после чего обсушиваем его, удаляя всю воду.
Далее необходимо замерить массу катода на весах (до начала эксперимента на них же уже должна быть замерена начальная масса катода). После чего все данные заносятся в таблицу:

Имея в наличии все данные, электрохимический эквивалент меди находится, исходя из первого закона Фарадея:

Решение более сложных задач
Условие задачи. Какое время понадобится на электролиз воды, чтобы полученным водородом наполнить шар с подъемной силой 2 кН? Сила тока электролиза – 200 А.
Начнем решение задачи с уравнения механики, а именно, второго закона Ньютона. На шар, накачанный таким образом, действует сила Архимеда, сила тяжести, и он движется с каким-то ускорением вверх (раз у него есть подъемная сила). См. рис. 3.

Второй закон Ньютона для данного случая выглядит как:

Спроецировав его на ось OY, получим:

Левая часть выражения и является подъемной силой шара:

Сила Архимеда по определению:

Если представить, что в шаре вместо водорода воздух, то:

Значит, выражение для подъемной силы можно преобразовать, как:

Теперь, чтобы связать массы водорода и воздуха, запишем для обоих случаев уравнение Менделеева-Клапейрона:

Так как и объем, и давление, и температура в обоих случаях совпадает, разделим уравнения одно на другое:

Теперь выражение для подъемной силы можно записать:

Массу выделившегося водорода запишем из первого закона Фарадея:

Подставив в выражение выше:

Отсюда время выражается как:

Подставив данные из условия и все встречающиеся константы, получим ответ:

Величины, используемые на практике
При промышленном покрытии методом электролиза используются единицы измерения, отличные от системы СИ, так как в промышленности порядки величин больше чем те, которые используются в задачах.
Так, заряд измеряется не в Кл, а в  . Перевод в Кл делается следующим образом:
. Перевод в Кл делается следующим образом:



Также для выражения электрохимических эквивалентов используется единица:


Список литературы
- Тихомирова С.А., Яворский Б.М. Физика (базовый уровень) – М.: Мнемозина, 2012.
- Генденштейн Л.Э., Дик Ю.И. Физика 10 класс. – М.: Илекса, 2005.
- Мякишев Г.Я., Синяков А.З., Слободсков Б.А. Физика. Электродинамика. – М.: 2010.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
Домашнее задание
- Определите массу серебра, которое выделилось на катоде при электролизе азотнокислого серебра за 2 часа, если к раствору приложено напряжение 2 В, а его сопротивление – 5 Ом.
- Электролиз проходил в течение 5 минут при силе тока 1,5 А. При этом на катоде выделилось 137 мг некоторого вещества. Что это за вещество?
- Электролизом получено 120 мг меди. Сколько серебра можно получить, если через соответствующий электролит пройдет то же количество электричества?
- *Почему вокруг раствора соли нет электрического поля, если внутри него много заряженных ионов?
Если вы нашли ошибку или неработающую ссылку, пожалуйста, сообщите нам – сделайте свой вклад в развитие проекта. 

interneturok.ru
Химик.ПРО – решение задач по химии бесплатно
Тэги ‘закон Фарадея’
Процесс электролиза
Записать уравнения процесса электролиза, которые протекают при электролизе растворов электролитов, определить продукты электролиза. Рассчитать массу металлов и объем газов (при нормальных условиях), выделяющихся на электродах. Дано: CuCl2 (раствор) – электролит, сила тока – 10 А, время 2 часа.
На катоде выделилось
При пропускании тока силой 2 A в течение времени 1 час 20 минут 25 секунд через водный раствор металл (II) хлорида на катоде выделилось 3,269 грамм металла. Рассчитайте атомную массу металла.
Электролиз раствора соли
Записать реакции электролиза на инертных электродах и вычислить массу вещества, полученного на катоде и объем газа, выделившегося на аноде, при электролизе раствора соли нитрата серебра (AgNO3), если время электролиза 20 минут, а сила тока I=2А, если выход по току Вт=100%. Какие вещества будут выделяться на электродах при замене инертного анода на металлический (Ag)?
Вычислите молярную массу эквивалента
Вычислите молярную массу эквивалента двухвалентного металла и назовите его, если известно, что при электролизе раствора хлорида этого металла в течение 2 часов при токе силой 2,5 А выделилось 19,33 грамм металла. Составьте схему электролиза соли.
Выход по току
При электролизе в течении 1часа водного раствора нитрата висмута (Bi(NO3)3) на катоде выделилось 14 грамм висмута (Bi). Выход по току составляет 94 %. Вычислите силу тока.
himik.pro
Решение химических задач
на закон Фарадея в курсе
средней школы
Условия задач см. в № 5/2005

ОТВЕТЫ И РЕШЕНИЯ
1.
Электролиз раствора нитрата никеля можно представить следующей схемой:

В процессе электролиза катион никеля принимает два электрона, превращаясь в атом. По закону Фарадея
m(Ni) = 59•20•3600/(2•96 485) = 22 г.
Ответ. m(Ni) = 22 г.
2.
Найти: I.
Решение
Электролиз раствора нитрата серебра можно представить следующей схемой:

В процессе электролиза катион cеребра принимает один электрон, превращаясь в атом.
Согласно закону Фарадея имеем:
I = 5•1•96 485/(108•36 000) = 0,12 А.
Ответ. I = 0,12 А.
3. Ответ. m(Cu) = 119,4 г.
4. Ответ. t = 86,6 c = 1,4 мин.
5. Ответ. m(Fe) = 278,6 г.
6. Ответ. I = 11,17 A.
7.
Найти: t.
Электролиз расплава хлорида железа(II) можно представить следующей схемой:

В процессе электролиза катион железа принимает два электрона, превращаясь в атом. Тогда согласно закону Фарадея
t = 20•2•96 485/(56•30) = 2297 c = 0,64 ч.
Ответ. t = 2297 c = 0,64 ч.
8. Ответ. I = 88,9 A.
9. Ответ. I = 77,68 A.
10.
Найти:  (KOH).
(KOH).
Электролиз расплава хлорида калия можно представить следующей схемой:

В процессе электролиза катион калия принимает один электрона, превращаясь в атом. Тогда масса калия по закону Фарадея равна:
m(K) = 39•5•7200/(1•96 485) = 14,55 г.
Взаимодействие калия с водой можно выразить следующим уравнением реакции:

х = 14,55•112/78 = 20,89 г,
y = 14,55•2/78 = 0,37 г.
Найдем массу раствора щелочи:
m(КОН) = 2000 + 14,55 – 0,37 = 2014,18 г,
 (КОН) = 20,89•100/2014,18 = 1,04%.
(КОН) = 20,89•100/2014,18 = 1,04%.
Ответ.  (KOH) = 1,04%.
(KOH) = 1,04%.
11.
Fe2(SO4)3 (р-р),
t = 0,5 ч,
I = 10 А,
 (HCl) = 30%.
(HCl) = 30%.
Найти:
Электролиз раствора сульфата железа(III) можно представить cледующей схемой:

В процессе электролиза катион железа принимает три электрона, превращаясь в атом. По закону Фарадея
m(Fe) = 56•10•1800/(3•96 485) = 3,48 г.
Найдем массу соляной кислоты (в пересчете на безводную), необходимую для полного взаимодействия с найденной массой железа:

х = 73•3,48/56 = 4,5 г.
Найдем массу 30%-го раствора соляной кислоты:
m(30%-го р-ра HCl) = 4,5•100/30 = 15 г.
Ответ. m(30%-го р-ра HCl) = 15 г.
12.
Дано:
Электролиз расплава хлорида алюминия можно представить следующей схемой:

В процессе электролиза катион алюминия принимает три электрона, превращаясь в атом. По закону Фарадея
m(Al) = 27•15•14 700/(3•96 485) = 20,57 г.
Найдем массу железа, которую можно получить из оксида железа(III) алюминотермическим методом, имея 20,57 г алюминия:

х = 20,57•112/54 = 42,66 г.
Ответ. m(Fe) = 42,66 г.
13.
Дано:
Al2(SO4)3 (р-р),
t = 300 мин,
I = 25 А,
 (КОН) = 12%,
(КОН) = 12%,
 (р-ра KOH) = 1,111 г/мл.
(р-ра KOH) = 1,111 г/мл.
_________________________
Найти: V(12%-го р-ра KOH).
Решение
Электролиз раствора сульфата алюминия можно представить cледующей схемой:

m(Al) = 27•25•18 000/(3•96 485) = 42 г.
Найдем массу гидроксида калия (в пересчете на безводное вещество), необходимую для полного взаимодействия с алюминием массой 42 г:

Найдем массу раствора KOH 12%-й концентрации:
m(12%-го р-ра КОН) = 87,11•100/12 = 725,9 г.
Найдем объем раствора щелочи:
V(12%-го р-ра KOH) = m/  = 725,9/1,111 = 653,4 мл.
= 725,9/1,111 = 653,4 мл.
Ответ. V(12%-го р-ра KOH) = 653,4 мл.
14. Ответ. V(20%-го р-ра H2SO4) = 735,7 мл.
15.
Электролиз раствора сульфата хрома(III) можно представить cледующей схемой:

В процессе электролиза катион хрома принимает три электрона, превращаясь в атом. По закону Фарадея масса хрома равна:
m(Cr) = 52•75•6000/(3•96 485) = 80,84 г.
Найдем объем оксида азота(IV), который выделится при взаимодействии при нагревании данной массы хрома с концентрированной азотной кислотой:
him.1september.ru