ВАНТ-ГОФФА ПРАВИЛО
ВАНТ-ГОФФА ПРАВИЛО. Почти все химические реакции при повышении температуры идут быстрее. Зависимость скорости реакции от температуры описывается уравнением Аррениуса:

k = Ae –E a/RT, где k – константа скорости реакции, А – не зависящая от температуры константа (ее называют предэкспоненциальным множителем), Еа – энергия активации, R – газовая постоянная, Т – абсолютная температура. В школьных учебниках зависимость скорости реакции от температуры определяют в соответствии с так называемым «правилом Вант-Гоффа», которое в 19 в. сформулировал голландский химик Якоб Вант-Гофф. Это чисто эмпирическое правило, т.е. правило, основанное не на теории, а выведенное из опытных данных. В соответствии с этим правилом, повышение температуры на 10° приводит к увеличению скорости в 2–4 раза. Математически эту зависимость можно выразить уравнением v2v1 = g (T2 – T 1 )/10 , где v1 и v2 – скорости реакции при температурах Т1 и Т2; величина g называется температурным коэффициентом реакции. Например, если g = 2, то при Т2 – Т1 = 50 о v2/v1 = 2 5 = 32, т.е. реакция ускорилась в 32 раза, причем это ускорение никак не зависит от абсолютных величин Т1 и Т2, а только от их разности.
Однако из уравнения Аррениуса следует, что температурный коэффициент реакции зависит как от энергии активации, так и от абсолютной температуры. Для данной реакции с определенным значением Еа ускорение при повышении температуры на 10° будет тем больше, чем ниже температура. Это почти очевидно и без расчетов: повышение температуры от 0 до 10° С должно сказаться на скорости реакции значительно сильнее, чем такое же повышение температуры, например, от 500 до 510° С.
С другой стороны, для данного температурного интервала ускорение реакции будет тем сильнее, чем больше ее энергия активации. Так, если энергия активации реакции мала, то такая реакция идет очень быстро, и при повышении температуры на 10° С ее скорость почти не изменяется. Для таких реакций температурный коэффициент намного меньше 2. Для реакций же с большой энергией активации, которые при невысоких температурах идут медленно, ускорение при повышении температуры на 10° С может значительно превысить 4-кратное.
Например, реакция диоксида углерода со щелочным раствором с образованием гидрокарбонат-иона (СО2 + ОН® НСО3 – ) имеет энергию активации 38,2 кДж/моль, поэтому при повышении температуры, например, от 50 до 60° С эта реакция ускорится всего в 1,5 раза. В то же время реакция распада этилбромида на этилен и бромоводород (С2Н5Вr ® С2Н4 + НВr) с энергией активации 218 кДж/моль ускорится при повышении температуры от 100 до 110 o С в 6,3 раза (правда, в этом интервале температур реакция идет очень медленно). Кинетика реакции атомов водорода с этаном H + C2H6 ® H2 + C2H5 была изучены в широком температурном интервале – от 300 до 1100 К (27–827° С). Для этой реакции Eа = 40,6 кДж/моль. Следовательно, повышение температуры на 10° вызовет увеличение скорости реакции в 1,7 раза в интервале 300–310 K и только в 1,04 раза в интервале 1090–1100 K. Так что при высоких температурах скорость этой реакции практически не зависит от температуры. А для реакции присоединения атома водорода к двойной связи H + C2H4 ® C2H5 энергия активации мала (Eа = 3,4 кДж/моль, так что ее скорость слабо зависит от температуры в широком температурном интервале. И только при температурах намного ниже 0° С начинает сказываться наличие активационного барьера.
Подобных примеров можно привести множество. Очевидно, что правило Вант-Гоффа противоречит не только уравнению Аррениуса, но и многим экспериментальным данным. Откуда же оно взялось и почему нередко выполняется?
Если в приведенном выше математическом выражении для правила Вант-Гоффа подставить вместо скоростей v1 и v2 для данной реакции их зависимости от температуры, в соответствии с уравнением Аррениуса, то после сокращения предэкспоненциальных множителей получим следующее выражение: g = vT +10/vT = е –Е а/R(Т+10)/е –Е а/RТ = е (Еа/R)[1/Т – 1/(T+10)] . Логарифмироване этого уравнения дает: lng = (Eа/R)[1/T – 1/(T + 10)], откуда Еа = Rlng T(T + 10)/10 = 0,83lngT(T + 10). Энергия активации не является функцией температуры, эта зависимость нужна лишь для удобства последующего анализа. Последнее уравнение – это уравнение параболы, в котором физический смысл имеют только положительные значения. Соответствующая диаграмма ограничена двумя ветвями параболы: при g = 2 получаем Еа = 0,58Т(Т + 10), при g = 4 получаем Еа = 1,16Т(Т + 10). К тем же формулам приходим и при использовании десятичных логарифмов. Соответствующие графики двух парабол, для значений g 2 и 4, приведены на рисунке. Их физический смысл заключается в том, что области выполнения правила Вант-Гоффа соответствует только область между параболами. Таким образом, существуют только определенные соотношения между энергией активации реакции и температурой ее проведения, при которых правило Вант-Гоффа выполняется. Ниже нижней ветви температурный коэффициент g 4.
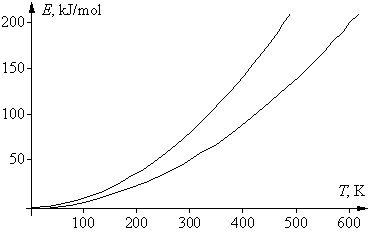
Если посмотреть, какие реакции «укладываются» в указанную довольно узкую область, то окажется, что все эти реакции идут не слишком быстро и не слишком медленно, а с удобной для измерения (при данной температуре) скоростью. Скорость только таких реакций и могли изучать химики во времена Вант-Гоффа. Например, если энергия активации была невелика (меньше 50 кДж/моль), то такая реакция при комнатной температуре заканчивалась за 1–2 секунды; поэтому для изучения ее кинетики следовало значительно понизить температуру, чтобы реакция проходила не быстрее, чем за 10–20 минут. Только в этом случае химики 19 в. успевали отбирать пробы по ходу реакции и анализировать изменение в них концентрации реагентов. Других способов изучения скорости реакции в то время не было. Если это не удавалось (например, водный раствор замерзал), то скорость такой реакции не изучали. Если же энергия активации реакции была велика и при комнатной температуре она шла слишком медленно (многие сутки, или даже недели), то температуру повышали, чтобы реакция шла с удобной для измерения скоростью. И здесь были свои ограничения – например, раствор мог закипеть, т.е. в любом случае исследователи фактически «подстраивали» изучаемую реакцию под область между двумя параболами.
Сейчас химики имеют возможность с помощью различных приборов экспериментально изучать и очень быстрые (идущие в микросекундной области), и очень медленные реакции, для которых температурный коэффициент может быть значительно меньше 2 или значительно больше 4. Поэтому правило Вант-Гоффа, которое, в отличие от уравнения Аррениуса, не имеет четкого физического смысла, представляет лишь чисто исторический интерес и в современной науке не используется. В подавляющем большинстве учебников и монографий по химической кинетике, а также в 5-томной Химической Энциклопедии это правило даже не упоминается. И, тем не менее, если изучаемая реакция идет с удобной для измерения скоростью, например, заканчивается за 30–40 мин, а энергия активации ее еще не измерена, то для предварительной грубой оценки зависимости скорости такой реакции от температуры можно использовать правило Вант-Гоффа. Поэтому это правило приводится во всех школьных учебниках химии.
www.krugosvet.ru
Закон вант гоффа и его математическое выражение


Если система, разделенная мембраной, представляет собой растворы, в которых через мембрану способны проходить только молекулы растворителя, то свойства ее будут определяться разностью мольных долей (концентраций) растворителя по обе стороны мембраны.
Явление, связанное со способностью проходить через мембрану, в частности, только молекул растворителя, называется осмосом , а вызываемое им изменение давления по обе стороны мембраны – осмотическим давлением . Явление осмоса чрезвычайно разнообразно и во многом определяется природой мембраны и компонентов раствора.

Представим, что сосуд с двумя горлами для залива раствора разделен мембраной M (рис. 6.4). В каждую часть сосуда зальем растворы, отличающиеся только концентрацией. Поскольку мольные доли растворителя по обе стороны мембраны не совпадают, то стремление их к выравниванию приведет к переходу части растворителя в ту часть сосуда, где концентрация растворенного вещества больше. Увеличение количества растворителя эквивалентно возрастанию давления, и если мембрана способна к деформации, она изогнется в сторону с меньшей концентрацией растворенного вещества (рис. 6.4а).
Если мембрана жесткая, то в отсеке с большей концентрацией количество растворителя будет возрастать до тех пор, пока гидростатическое давление h (рис. 6.4б) не станет равным осмотическому давлению и не прекратит осмос.
chemistry.ru
ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ. Правило Вант-Гоффа
С повышением температуры скорость реакции увеличивается. Зависимость скорости реакции от температуры приближенно описывается эмпирическим правилом Вант-Гоффа: при повышении температуры на каждые 10° скорость реакции увеличивается в 2-4 раза.
Математическое выражение правила Вант-Гоффа:
а при условии, что концентрации всех реагирующих веществ равны 1 моль/л:
где  ,
,  и
и  ,
,  — соответственно скорости и константы скоростей реакции при температурах
— соответственно скорости и константы скоростей реакции при температурах  и
и  .
.
Температура может быть выражена как в °С, так и в К, так как изменение температуры не зависит от единиц измерения ( ).
).
 — температурный коэффициент скорости реакции, который показывает, во сколько раз возрастает скорость реакции при повышении температуры на 10 градусов:
— температурный коэффициент скорости реакции, который показывает, во сколько раз возрастает скорость реакции при повышении температуры на 10 градусов:
Поскольку при концентрациях реагирующих веществ 1 моль/л скорость химической реакции численно равна константе скорости  , то
, то
Учитывая тот факт, что скорость реакции обратно пропорциональна времени ее протекания из уравнения (18), при  получаем
получаем
Используя уравнения (16 – 20), можно рассчитать:
— константу скорости (или скорость) реакции при заданной температуре, если известны значения этих величин при двух других температурах;
— на сколько градусов надо повысить (или понизить) температуру реакции, чтобы скорость ее увеличилась (или уменьшилась) в N раз;
— при какой температуре следует проводить реакцию, чтобы она закончилась за определенное время, если известны температурный коэффициент реакции и скорость ее при любой температуре;
— температурный коэффициент реакции и т. д.
einsteins.ru
Вант-Гоффом, который предложил эту схему, содержит смесь N2, H2 и NH3 в равновесии при некотором данном давлении р и температуре t, причем и р и t остаются постоянными. Цилиндры В, С и D при некотором данном давлении р0 содержат, соответственно, Н2, N2 и NH3, а непроницаемые затворы предохраняют их содержимое от соприкосновения с газами в ящике. Заметим, что D теперь считается цилиндром с поршнем, связанным с рабочим механизмом, так же как и цилиндры В и С — При смешении газов с помощью полупроницаемых мембран Н2 и N2 расширяются изотермически и обратимо от своих исходных давлений до таких давлений, которые они имели бы, находясь с помощью полупроницаемых мембран в равновесии со смесью в ящике, ( Для идеальных газов давление было бы равно парциальному давлению соответствующего газа в ящике. Затем, так же как и раньше, непроницаемые затворы заменяют полупроницаемыми мембранами, и газы нагнетаются в ящик. Так как это нарушает равновесие в ящике, то будет образовываться NH3, и с той же скоростью, с которой он образуется, он проникает в D через полупроницаемую мембрану.
Вант-Гоффом, который допустил способность атомных групп, соединенных простой связью, вращаться вокруг связующей их оси, а также возможность возникновения при вращении этих групп наиболее вероятных энергетических положений, которые исключают особо устойчивое ( факсированное) положение групп. Например, в молекуле этана С2Й6 метальные группы испытывают вращение друг относительно друга.
Вант-Гоффом было разработано математическое выражение кинетических закономерностей.
Вант-Гоффом еще в 1875 и подтвержден в 1935 на примере 1 3-дифенил — или 1 3-ди-вафтилаллена.
Общий характер. Вант-Гоффом установлено простое эмпирическое правило, согласно которому скорость реакции при повышении температуры на 10 возрастает в 2 — 4 раза.
Вант-Гоффом ( 188П), С noMiinibso уравнения изотермы реакции опреле-ляют возможность или невозможность реакции при данных условиях. Следовательно, для гого чтобы химическая реакция имела место, значение V7 должно быть отрицательным; если значение AG положительно, реакция не может протекать.
Вант-Гоффом было разработано математическое выражение кинетических закономерностей.
Вант-Гоффом в 1889 г. Оно выражает закон Вант-Гоффа; осмотическое давление раствора равно тому давлению, которое производило бы растворенное вещество, если бы оно в виде идеального газа занимало объем, равный объему раствора при той же температуре.
Вант-Гоффом установлено эмпирическое правило, согласно которому скорость большинства химических реакций при повышении температуры на 10 увеличивается в 2 — 4 раза.
Кристаллическая решетка льда. Вант-Гоффом и др. Колдигативными называют такие свойства, которые зависят только от концентрации растворенных веществ, но не от химической природы.
Вант-Гоффом было разработано математическое выражение кинетических закономерностей.
Вант-Гоффом, который допустил способность атомных групп, соединенных простой связью, вращаться вокруг связующей их оси, а также возможность возникновения при вращении этих групп наиболее вероятных энергетических положений, которые исключают особо устойчивое ( факсированное) положение групп. Например, в молекуле этана СаНе метальные группы испытывают вращение друг относительно друга.
Вант-Гоффом еще в 1875 и подтвержден в 1935 на примере 1 3-дифенил — или 1 3-ди-нафтжлаллена.
Закон Вант-Гоффа справедлив лишь для разбавленных растворов неэлектролитов. Отклонения от закона, и весьма значительные, имеют место в растворах неэлектролитов высокой концентрации и в растворах электролитов любой концентрации.
Метод Вант-Гоффа заключается в следующем.
Уравнения Вант-Гоффа позволяют рассчитать — hGATp и — & FATjV обратимой реакции для заданного состава реакционной смеси и определить, в каком направлении и до какого предела может протекать реакция в данных условиях.
Закон Вант-Гоффа многократно проверялся опытным путем, причем он для разбавленных растворов неэлектролитов вполне подтвердился.
Формула Вант-Гоффа применима только для истинных растворов, так как в этом случае осмотическое давление пропорционально числу молекул. Поэтому при определении молекулярного веса высокомолекулярных веществ необходимо применять весьма разбавленные растворы, свойства которых приближаются к свойствам истинных растворов. Прежде чем применять формулу Вант-Гоффа, необходимо установить ее пригодность для выбранной концентрации исследуемого вещества.
Закон Вант-Гоффа формулируется так: осмотическое давление разбавленного раствора пропорционально его молярной концентрации и абсолютной температуре.
Закон Вант-Гоффа: все разбавленные растворы проявляют осмотическое давление, численно равное тому газовому давлению, которое оказывало бы растворенное вещество, если бы оно находилось в газообразном состоянии и занимало бы объем, равный объему раствора.
Правило Вант-Гоффа дает приближенный результат, поскольку изменяется с температурой. Равновесие смещается слева направо. Равновесие смещается слева направо. Реакция протекает в обратном направлении.
Уравнение Вант-Гоффа показывает, что осмотическое давление равно тому давлению, которое производило бы растворенное вещество, если бы оно в виде идеального газа занимало тот же объем, что и в растворе при той же температуре. Уравнение (126.11) правильно передает зависимость осмотического давления от концентрации и температуры. Универсальная газовая постоянная R, рассчитанная из данных по осмотическому давлению раствора, совпадает с величиной, полученной при изучении газов.
Правило Вант-Гоффа является весьма грубым и применимо только в очень ограниченном интервале температур.
Учение Вант-Гоффа не могло быть, на наш взгляд, безоговорочно признано А. М. Бутлеровым не только по указанным мотивам, но еще и потому, что, принимая постоянное движение атомов в молекулах, А. М. Бутлерову трудно было признать за отображение объективной реальности некую стандартную модель с покоящимися в вершинах правильного тетраэдра, различными по массе и химической природе, атомами или атомными группами, изображающую молекулы с асимметрическим атомом углерода.
Правило Вант-Гоффа является приближенным и применимо лишь для ориентировочной оценки влияния температуры на скорость реакции. Температура влияет на скорость химической реакции, увеличивая константу скорости.
Закон Вант-Гоффа, так же как и закон Рауля для давления пара растворителя (2.46), закон Генри для давления пара растворенного вещества (2.45), хриоскопическая (2.68) и эбулиоскопическая (2.79) формулы представляют со — 45ой примеры предельных законов бесконечно разбавленных растворов.
Уравнение Вант-Гоффа применимо только для разбавленных растворов.
Правило Вант-Гоффа: увеличение температуры на 10 С, как правило, приводит к ускорению химических процессов в 2 — 3 раза. Это важно при изменении температуры организмов и окружающей среды.
Уравнение Вант-Гоффа и уравнение (14.17) полностью решают задачу расчета констант равновесия из термодинамических характеристик компонентов реакции.
Метод Вант-Гоффа заключается в следующем.
Модели Вант-Гоффа позволяют поэтому предсказать лишь число пространственных изомеров. Истолкование течения реакции с их помощью невозможно. Это выходит далеко за пределы действительного содержания тетраэдрической теории Вант-Гоффа. В настоящее время мы знаем, что в первом из исследованных примеров, при окислении перманганатом, имеется однозначное цис-присоединение.
Работы Вант-Гоффа послужили основанием к осознанному отграничению именно таких случаев упрощения, или идеализации, объекта от изучения реальных кинетических систем, как правило, осложненных действием среды. Соответственно этому и исследования в области химической кинетики с середины 1880 — х годов осуществлялись как бы на двух уровнях: уровне нарочитого упрощения с целью установления закономерностей, присущих химическому процессу в чистом виде, и на уровне преднамеренного поиска количественных зависимостей хода реакций от множества факторов среды.
Соотношение Вант-Гоффа — Димрота, конечно, можно выразить и через мольные доли.
Закон Вант-Гоффа: осмотическое давление численно равно тому давлению, которое оказывало бы растворенное вещество, если бы оно при данной температуре находилось в состоянии идеального газа и занимало объем, равный объему раствора.
Правило Вант-Гоффа является приближенным и применимо лишь для ориентировочной оценки влияния температуры на скорость реакции. Температура влияет на скорость реакции, увеличивая константу скорости.
Коэффициент Вант-Гоффа можно определить, измерив непосредственно осмотическое давление исследуемого раствора осмометром Пфеффера, что сложно, или криометрическим методом, что значительно проще.
Закон Вант-Гоффа позволяет вычислить осмотическое давление раствора, если известны его концентрации и температура. Основа: нием для расчетов могут служить следующие рассуждения.
Правило Вант-Гоффа утверждает, что при повышении температуры на каждые 10 скорость реакции ( константа скорости) увеличивается IB 2 — 4 раза.
Правило Вант-Гоффа весьма приближенное.
Закон Вант-Гоффа справедлив для разбавленных растворов неэлектролитов. Растворы с одинаковым осмотическим давлением называют изотоническими. С помощью закона Вант-Гоффа можно вычислять молекулярные веса растворенных веществ.
Уравнение Вант-Гоффа применимо лишь к идеальным или разбавленным растворам. Однако это уравнение с некоторыми оговорками может быть использовано и при рассмотрении коллоидных растворов.
Схема прибора для измерения осмотического давления раствора. Закон Вант-Гоффа справедлив для разбавленных растворов электролитов. В концентрированных растворах наблюдаются отклонения от закона Вант-Гоффа, но еще большие отклонения от него дают водные растворы электролитов.
Правило Вант-Гоффа является приближенным и применимо лишь для ориентировочной оценки влияния температуры на скорость реакции. Температура влияет на скорость химической реакции, увеличивая константу скорости.
Правило Вант-Гоффа применяется для ориентировочных расчетов.
www.ai08.org
Популярная химия
Главное меню

Зависимость скорости протекания химической реакции от температуры определяется правилом Вант-Гоффа.
Голландский химик Вант-Гофф Якоб Хендрик, основатель стереохимии, в 1901 г. стал первым лауреатом Нобелевской премии по химии. Она была присуждена ему за открытие законов химической динамики и осмотического давления. Вант-Гофф ввёл представления о пространственном строении химических веществ. Он был уверен, что прогресса в фундаментальных и прикладных исследованиях по химии можно достичь, применяя физические и математические методы. Разработав учение о скорости реакций, он создал химическую кинетику.
Скорость химической реакции

Итак, кинетикой химических реакций называют учение о скорости протекания, о том, какое химической взаимодействие происходит в процессе реакций, и о зависимости реакций от различных факторов. У различных реакций скорость протекания различна.
Скорость химической реакции напрямую зависит от природы химических веществ, вступающих в реакцию. Некоторые вещества, такие как NаОН и НCl, способны реагировать за доли секунды. А некоторые химические реакции длятся годами. Пример такой реакции – ржавление железа.
Скорость реакции зависит также и от концентрации реагирующих веществ. Чем выше концентрация реагентов, тем выше и скорость реакции. В ходе реакции концентрация реагентов уменьшается, следовательно, замедляется и скорость реакции. То есть, в начальный момент скорость всегда выше, чем в любой последующий.
Скоростью химической реакции принято считать изменение концентрации реагирующих веществ в единицу времени.
Концентрации реагентов определяют через определённые промежутки времени.
Правило Вант-Гоффа

Важным фактором, от которого зависит скорость протекания реакций, является температура.
Все молекулы сталкиваются с другими. Число соударений в секунду очень велико. Но, тем не менее, химические реакции не протекают с огромной скоростью. Так происходит, потому что в ходе реакции молекулы должны собраться в активированный комплекс. А образовать его могут только активные молекулы, кинетической энергии которых достаточно для этого. При малом количестве активных молекул реакция протекает медленно. При повышении температуры увеличивается число активных молекул. Следовательно, и скорость реакции будет выше.
Вант-Гофф считал, что скорость химической реакции – это закономерное изменение концентрации реагирующих веществ в единицу времени. Но оно не всегда является равномерным.
Правило Вант-Гоффа гласит, что при повышении температуры на каждые 10 о скорость химической реакции увеличивается в 2-4 раза.
Математически правило Вант-Гоффа выглядит так:

где V2 – скорость протекания реакции при температуре t2, а V1 – скорость протекания реакции при температуре t1;
ɣ — температурный коэффициент скорости реакции. Этот коэффициент есть отношение констант скоростей при температуре t+10 и t.
Так, если ɣ = 3, а при 0 о С реакция длится 10 минут, то при 100 о С она будет продолжаться всего 0,01 сек. Резкое увеличение скорости протекания химической реакции объясняется увеличением количества активных молекул при повышении температуры.
Правило Вант-Гоффа применимо только в температурном диапазоне 10-400 о С. Не подчиняются правилу Вант-Гоффа и реакции, в которых участвуют большие молекулы.
ximik.biz