Закон сеченова и дальтона
15. Растворимость газов в жидкостях. Законы Генри—Дальтона и Сеченова
Растворение газов в жидкостях почти всегда сопро–вождается выделением теплоты. Поэтому раствори–мость газов с повышением температуры согласно принципу Ле Шателье понижается. Эту закономер–ность часто используют для удаления растворенных га–зов из воды (например С02 ) кипячением. Иногда рас–творение газа сопровождается поглощением теплоты (например, растворение благородных газов в некото–рых органических растворителях). В этом случае повы–шение температуры увеличивает растворимость газа.
Газ не растворяется в жидкости беспредельно. При не–которой концентрации газа X устанавливается равно–весие:
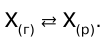
При растворении газа в жидкости происходит значи–тельное уменьшение объема системы. Поэтому повы–шение давления согласно принципу Ле Шателье долж–но приводить к смещению равновесия вправо, т. е. к увеличению растворимости газа. Если газ малораст–ворим в данной жидкости и давление невелико, то растворимость газа пропорциональна его давлению. Эта зависимость выражается законом Генри (1803г.): количество газа, растворенного при данной тем–пературе в определенном объеме жидкости, при равновесии прямо пропорционально давлению газа.
где – концентрация газа в насыщенном раство–ре, моль/л;
Kr(X) – постоянная Генри для газа X, моль?л-1 ? Па -1 .
Константа Генри зависит от природы газа, рас–творителя и температуры.
Закон Генри справедлив лишь для сравнительно раз–бавленных растворов, при невысоких давлениях и отсут–ствии химического взаимодействия между молекулами растворяемого газа и растворителем.
Закон Генри является частным случаем общего закона Дальтона. Если речь идет о растворении не одного газооб–разного вещества, а смеси газов, то растворимость каж–дого компонента подчиняется закону Дальтона: раство–римость каждого из компонентов газовой смеси при постоянной температуре пропорциональна парциаль–ному давлению компонента над жидкостью и не зави–сит от общего давления смеси и индивидуальности других компонентов.
Иначе говоря, в случае растворения смеси газов в жидкости в математическое выражение закона Генри вместо подставляют парциальное давление р! дан–ного компонента.
Под парциальным давлением компонента понимают долю давления компонента от общего давления газовой смеси:
Парциальное давление компонента рассчитывают по формуле
Изучая растворимость газов в жидкостях в присутст–вии электролитов, русский врач-физиолог И. М. Сече–нов (1829—1905) установил следующую закономерность (закон Сеченова): растворимость газов в жидкостях в присутствии электролитов понижается; происходит высаливание газов.
где pi – парциальное давление компонента Хi;
Изучая растворимость газов в жидкостях в присутствии электролитов, русский враччфизиолог И. М. Сеченов (1829—1905) установил следующую закономерность (закон Сеченова): растворимость газов в жидкостях в присутствии электролитов понижается; происходит высаливание газов.
www.nnre.ru
Рефераты и конспекты лекций по географии, физике, химии, истории, биологии. Универсальная подготовка к ЕГЭ, ГИА, ЗНО и ДПА!
Химия — рефераты, шпаргалки, семинары, конспекты, лекции
Растворимость газов в жидкостях
Как правило, газы незначительно растворяются в жидкостях. Их растворимость возрастает при повышении давления и уменьшается при повышении температуры. В основе процесса растворения газов заключается явление диффузии.
Растворимость газов в жидкостях подчиняется закону В. Генри (1803).
При постоянной температуре растворимость газа в данном объеме жидкости прямо пропорциональна давлению этого газа над жидкостью
где С — весовая концентрация газа в насыщенном растворе;
Р — давление газа;
К — константа Генри.
Подобную зависимость для смеси газов открыл Дальтон.
Поскольку общее давление газовой смеси равно сумме парциальных давлений
Рзаг = Ри + Р2 + . + Р, (3.11)
то растворимость каждого из компонентов газовой смеси пропорционально его парциальному давлению (Р1, Р2, . Ри-парциальные давления газа в газовой смеси).
Закон Дальтона является дополнением к закону Генри, и сейчас они объединены в один закон — закон Генри — Дальтона. Этот закон справедлив, если условия приближаются к идеальным, он имеет большое значение в биологии и заслуживает более детальное обсуждение. Вот некоторые примеры проявлений закона Генри — Дальтона: кессонная болезнь (закупорка пузырьками газа кровеносных сосудов), образование пены при открывании бутылок с минеральной водой, шампанским и т.д.. В биологических системах наблюдаются несколько типов отклонения от закона Генри:
1. И. М. Сеченов изучал закономерности поглощения углекислого газа физиологическими жидкостями и доказал, что растворимость углекислого газа уменьшается при наличии в растворителе электролитов.
1. Сеченов доказал, что 2/3 всего углекислого газа растворяется в плазме крови, а 1/3 связывается с эритроцитами, и процесс перехода углекислого газа из крови в легкие подобен диффузии газа из жидкости в воздух. На основании этих исследований И. М. Сеченов определил роль гемоглобина в переносе углекислого газа и кислорода.
2. Второй тип отклонение может происходить при химическом взаимодействии газа с растворителем. Так, наблюдается аномально высокая растворимость СО2 в организме при различных процессов обмена. В живых организмах гидратация и дегидратация CO2 катализируется ферментом карбоангидразы.
3. Третий тип отклонений характеризуется поведением кислорода в крови. Обычно кислород ограничено растворяется в воде. Его растворимость резко возрастает при наличии гемоглобина за счет связывания кислорода с гемоглобином атомами железа, входящих в гем. Качественное объяснение заключается в том, что молекула гемоглобина состоит из четырех субъединиц. Таким образом, зная рН раствора, можно вычислить рОН. На практике в основном применяются значения рН в интервале от 1 до 14. Может быть и отрицательное значение рН. Например, раствор соляной кислоты концентрации 10 моль / л имеет рН == — lg 10 = — 1. Раствор NaOH концентрации 10 моль / л имеет рН = 15.
Для концентрированных растворов сильных кислот и оснований ионное произведение воды перестает быть точным, так как наблюдается взаимное влияние ионов.
worldofscience.ru
химия-экзамен. 1. растворимость газов. Закон Генри, Дальтона,Сеченова

1.растворимость газов.Закон Генри, Дальтона ,Сеченова.
Растворение газа в жидкости почти всегда сопровож-ся выдел-м теплоты, поэтому растворим-сть газа с повыш-м темепер-ры понижается. Однако иногда растворе- газа сопровож-ся поглощением теплоты(например, растворение благород. газов в орган. растворах); в этом случае повышение температуры увеличивает растворимость газа.
Газ в жидкости не растворяется беспредельно. При растворении происходит уменьшение обьема системы, поэтому повышение давления должно приводить к увеличению растворимости газа. Если газ малорастворим и давление мало, то раствор-сть газа пропорциональна его давлению. Эта зависимость выражена в законе Генри :кол-во газа, растворенного при данной температуре в определенном объеме жидкости, при равновесии прямо пропорционально давлению газа.с(Х)=Кг(Х)р(Х) , где с(Х)-концентрация газа в насыщ. растворе,моль/л, p(Х)-давление газа Х над раствором, ПА, Кг(Х)- постоянная Генри для газа Х, моль*л в минус первой*па в минус первой. Константа генри зависти от природы газа, растворителя и температуры.
Закон Генри является частным случаем общего закона Дальтона (если речь идет о растворении смеси газов, то растворимость подчиняется этому закону) : растворимость каждого компонента газовой смеси при постоянной темпер-ре пропорциональна парциальному давлению компонента над жидкостью и не зависти от общего давления смеси и индивидуальности других компонентов. Под парциальным давлением понимается доля давления компонента от общего давления газовой смеси, рассчитывается по формуле рi = pобщx(Xi), где pi— парциальное давление компонента Xi, робщ- общее давление газовой смеси, х(Хi)-молярная доля i-го компонента.
Закон Сеченова : растворимость газоа в жидкостях в присутствии электролитов понижается; происходит высаливание газа! Одной из причин уменьшения растворимости газа в присутствии электролита явл. гидратация ионов электролитов молекулами растворителя, в результе умень-тся число свобод молекул расторителя, т.е. его растворяющая способность. Формула:с(Х)+Со(Х)е в степени –КсСэ, где С(Х)-растворимость газа Х в чистом растворителе, Сэ-концентрация электролита, Кс-константа Сеченова, кот зависти от природы газа, электорлита и температуры.Законы Г, Д, С имеют большое практическое значение в химии, медицине., т.к используются при лечении ряда заболеваний, при кот накапливаются микробы в омертвевших тканях (напр, газовая гангрена).
2. Строение коллоидной мицеллы.
Коллоидные частицы представляют собой образования со сложной структурой – мицеллы. М состоит из электорнейтрального агрегата и ионогенной части. Масса М сосредоточена в агрегате, кот состоит из множества атомов и молекул. Агрегат может иметь как аморфное так и кристалл-ое строение. Ионогенная часть М делиться на адсорбционный и диффузные слои. В рез-те избирательной адсорбции ионов или ионизации поверхностных молукул, агрегат приобретает заряд. Ионы, определяющие заряд агрегата, наз-ся потенциалопределяющими, и агрегат с этими потенциалопределяющими ионами образуют ядро! С заряженной поверхностью ядра связано некоторое кол-во ионов противоположного знака – противоионы. Потенциалопределяющие ионы и противоионы образуют адсорбционный слой. А агрегат с адсорбциооным слоем называют гранулой. Заряд гранулы равен сумме зарядов противо- и потенциалопределяющих ионов. Напр: золь AgCl, стабилизатор AgNO3: x(+)*xNO3(-) частица +,золь AgCl,стабилиз NaCl(избыток)(x+)*xNO3(-)слюна- кол. сист. сост. из мицелл фосфата кальция xCa(2+)Конц. Фосфата в слюне в 2 раза выше.,чем концентр кальция
1.Катализ.Основные понятия, свойства катализаторов, механизм гомогенного катализа. Особенности ферментов.
Катализом называют селективное изменение скорости хим реакции веществом , которое участвует в реакции, но кол-во и состав которого не меняется к моменту образования конечных продуктов. Есть 2 типа катализа: положительный(когда скорость возрастает), и отрицательный (когда скорость реакции уменьшается), но обычно термин катализ относиться к положит К.Все каталитические реакции подразделяются на гомогенные и гетерогенные. Если реагирующие вещ-ва и катализатор наход-ся в разнх фазах, катализ наз-ся ГЕТЕРОГЕННЫМ1 (пример: синтез аммиака из азота и водорода в присутствии метелического железа). Если реагир-ее вещ-во и катализатор нах-ся в одной фазе, катализ наз-ся ГОМОГЕННЫМ! (пример: разложение водородопероксида в присутствии солей Fe(II) в водных растворах.РЕАКЦИЯ:2H2O2-2H2O + O2над стрелочкой Fe2+ (1)
Каталитический распад происходит по следующему мех-му:
0, то катализатор не может заставить реакцию идти. Существуют вещества, снижающие активность катализатора — этоКАТАЛИТИЧЕСКИЙ ЯД. Вещ-во, усиливающее активность К, наз-ся АКТИВАТОРОМ!
Все реакции каталитического разложения представляют собой сложные многостадийные процессы. Роль каталитических реакций велика при жизнедеятельности организмов; большинство реакций в организмах протекает при участии биологических катализаторов-ФЕРМЕНТАХ.. Характерной особенностью Ф явл. их специфичность: свойство изменять скорость реакции одного типа и не влиять на многие др реакции, протекающие в клетке! В состав большинства ферментов входит ион металла, поэтому эти биологические катализаторы наз-ся металлоферментами! Типичным ферментом явл-ся КАТАЛАЗА!
Особенностями ферментов явл: 1) высокая активность 2) высокая специфичность 3) тонкий механизм регулировки активности деят-ти ферменотов с пом ЭФФЕКТОРОВ (активаторы, ингибиторы) 4) высокая чувств-ть к внешним условиям!
2. Адсорбция электролитов. Правило фаянса. Лиотропные ряды. Ионообменная адсорбция. Химическая адсорбция.
Адсорбция(Г) – самопроизв изменение концентрации раствор-ого вещ-ва на границе раздела фаз, измеряется в моль/см(2) или моль\м(2). В рас-рах сильн электролитов растворенное вещ-во нах в полностью ионизированном состоянии, поэтому их А имеет ряд особенностей!основными факторами, влияющими на специфичность А сильных электролитов явл. знак заряда поверхности адсорбента, величина и знак заряда иона, его радиус и степень сольватации! На положительно заряж поверхности адсорбента адсорбируются АНИОНЫ, на отрицательно заряженных – КАТИОНЫ!
Адсорбционная способность ионов возрастает с увеличением их заряда. Кроме того, адсорбционная способность больше у тех ионов, радиус которых в сольватированном состоянии меньше. С соответствии с этим правилом, ионы по их адсорбционной способности располагаются в опред последовательности, кот наз-ся ЛИОТРОПНЫЕ РЯДЫ!Cs(+)>Rb(+)>NH4(+)>K(+)>Na(+)>LI(+) (уменьшение адсорбции, уменьшение радиуса иона, пм)NO3(-)>I(-)>Br(-)>CL(-)>F(-)-(257, 216, 195, 181, 136)
Есть 3 вида адсорбции: эквивалентная, избирательная и обменная! ЭА встречается редко, характеризуется тем, что катионы и анионы адсорбируются на поверхности адсорбента в эквивалентных кол-вах. ИА -подчиняется правилу амер. физико-химика К.Фаянса:на поверхности адсорбента преимущественно адсорбируются те ионы, кот. могут достраивать кристалическую решетку этого адсорбента!пример-зарядка поверхности кристалического осадка серебра иодида. Ионнообменная А –процесс,в котором адсорбент и раствор обмениваются одноименно заряженными ионами в эквивалентных кол-вах. Например: RM1+M2(+)(еще обратная стрелка) RM2+M1(+), где RM1-адсорбенты, содержащие катион M1и способные к обмену с катионом М2 в растворе.получили название ионитов-твердые природные или синт вещ-ва, практически нерастворимые в воде!ИОННЫЙ ОБМЕН-процесс обратимый, что дает возможность регенирировать иониты(промыв кислотой и щелочью).
Х.А – между адсорбантом и адсорбентом протекает реакция, образ. хим связи и образ новое соединение. Хемосорбция необратима, а физич. обратима. Теплота хим адсорбции >> физч ад.Е активации физич адсор =0. С повышением температуры физич адсор уменьшается, а хим-увеличивается!Хромотография — динамич метод анализа, основан на многократно повторяющ-ся прцесах сорбции и десорбции! Выделяют 2 фазы: неподвижная-адсорбент, подвижная – которая фильтруется ч\з неподвижную фазу вместе с разделяемыми вещ-вами! Её используют в анализе крови на алког, и наркотики!
1.Диссоциация воды. Водородный показатель(рН)среды. Ионное произведение воды.
Согласно теории Бренстеда процесс Д воды протекает по уравнению H2O+ H2O(обр стрл) H3O(+) +OH(-); dH(0)==56, 5 кДж/моль!т.е одна молекула воды отдает, а др присоединяет протон, происходит автоионизация воды. Константа воды при 298К равна 1, 8*10(-16) моль\литр.(Кд(Н2О)= а(Н+)*а(ОН-)/а(Н2О)=1, 8*10(-16) моль \литр!), где а(Н+), а(ОН-), а(Н2О)-активности ионов и воды.Вода слабый амфотерный электрлит,степень Д воды мала, поэтому активности водород- и гидроксид-ионов в чистой воде почти равна их концентрациям. Константа диссоциации воды К(Н2О) наз-ся ионным произведением или константой автоионизации воды. В чистой воде или любом водном растворе при постоянной температуре произведение концентраций (активностей) водород- и гидроксид ионов есть величина постоянная, называется ионным произведением воды! Ионное произведение позволяет вычислить концентрацию гидроксид- ионов , если известна концентрация ионов водорода и наоборот., т.к. они взаимозависимы.Константа зависти от Темпер: при повышении темперутуры константа увеличивается, т.к. процесс Д воды –эндотермический!(напр, при темп 310 К константа =3,13*10(-14), а при т 373=5, 9 8*10 (-13). В водных растворах разных веществ константа имеет тоже значение, что и для чистой воды.В водных растворах различают 3 вида сред: нейтр, щелоч и кислую. Для харак-ки сред растворовиспользуют концентрации водород-ионов, но более удобно использовать так наз водородный показатель рН –называется отрицательный десятичный логарифм концентрации ионов водорода:рН=-lg[H+]! В нейтр. Среде Н(+)= 10(-7) моль\литр рН=7, 0; в кислой> 10(-7) моль\литр, рН 7,0. Таким образом чем рН меньше 7, тем больше кислотность раствора, чем рН больше 7, тем больше щелочность раствора!Сущ-ет разл методы измерения рН, напр., с пом индикаторов (лакмус, фенолфталеин и метилоранж) вещ-ва кот, обратимо изменяют свой цвет в зависимости от рН раствора. *Одно из свойств живых организмов- постоянство рН биологических жидкостей, тканей и органов!причем рН различных жидкостей изменяется в завис-ти от их местонах-я! Так, рН крови-7, 4, рН жел сока
1! Смещение рН крови в кислую область наз-ся АЦИДОЗОМ, а в щелочную-АЛКАЛОЗОМ!!
2.СвойстваВМС.Набухание.ВязкостьрастворовВМС(ур.Штаудингера).Осмотическое давление(уравнение Галлера)
ВМС-вещ-ва, молекулы кот состоят из очень большого числа (>10(3)) химически связанных атомов. Повтряющаяся структурная единица ВМС-мономерное звено, кот повторяется n –раз.ВМС могут нах-ся в крист,аморфн.,жидк виде. Есть 2 класса ВМС по типу мономерных звеньев: полимеры(получаются по реакции полимеризации; пример:полиэтилен, каучук) и прочие ВМС(получаются по реакции поликонденсации; пример: белки, полиамиды, полисахариды. Растворы ВМС быв по структуре: линейные(желатин,каучук(,разветвл(крахмал),лестничные(целлюлоза),сетчатые(трехмерные полимеры)Свой-ва полимеров имен-ся при добаве низкомолек соединений;1) Пластификация- повышение пластичности П при небольшом кол-ве НМС.!R=k*корень из M 2)Набухание—процес проникновения растворителя в полимерное вещество,сопровождаемый увеличением объема и массы образца. (молекулы НМС обладают большей подвижностю и при набухании проник внутрь, раздвигая цепи, увеличивая объем) Количественно Н измер-ся степенью набухания &м=м-м0:м0 или &v=V-Vo:Vo,где м0-нач масса,V-объем набух образца. При Н изменяются ЭНТАЛЬПИЯ(незначительно) и ЭНТРОПИЯ(dGнабух.=dG1,2=dG2,3) dG набухания отрицательна(dG2,3=-TdS2,3 dHкр, т.е. dH раств
topuch.ru
Законы Генри, Дальтона, Сеченова. Применение этих законов при лечении кессонной болезни, лечении в барокамере и исследовании электролитного состава крови
Количество газа, растворенного при данной температуре в определенном объеме жидкости, при равновесии прямо пропорциональны давлению газа.
С(Х) – концентрация газа в насыщенном растворе, моль \ л
Кг(Х) – константа Генри, зависит от природы, растворителя и температуры, моль \ л
Р(Х) – давление, Па
Закон генри лежит в основе кессонной болезни (у водолазов). При погружении происходит увеличение давления, а следовательно и растворимости газа в крови. При быстром подъеме с больших глубин происходит мгновенное выделение пузырьков газа за счет резкого уменьшения растворимости из-за падения давления. Пузырьки закупоривают кровеносные сосуды, что приводит к тяжелому поражению тканей и даже гибели.
Растворимость каждого из компонентов газовой смеси при постоянной температуре пропорциональна парциальному давлению компонента над жидкостью и не зависит от общего давления смеси.
Pi – парциальное давление компонента Xi
Pобщ – общее давление газовой смеси
χ(Xi) – молярная доля i-того компонента
при лечении газовой гангрены и ряда других заболеваний, при которых накапливаются микробы в омертвевших тканях, больных помещают в барокамеры с повышенным давлением кислорода в воздухе. При этом улучшается снабжение тканей кислородом, сто дает хорошие результаты.
Растворимость газов в жидкостях в присутствии электролитов понижается, происходит высаливание газов
С(Х) – растворимость газа Х в присутствии электролита
С0(Х) – растворимость газа Х в чистом растворителе
Сэ – концентрация электролита
Кс – константа Сеченова (зависит от природы газа, электролита, температуры)
В соответствии с законом Сеченова не только электролиты, но и белки, липиды и другие вещества, содержание которых в крови может меняться в известных пределах, оказывают существенное влияние на растворимость кислорода и углекислого газа в крови.
Коллигативные свойства разбавленных растворов. Давление пара над раствором, причины его уменьшения. Расчет давления пара над раствором (закон Рауля). Относительное понижение давления пара над раствором.
Некоторые свойства раствора зависят от теплового движения частиц, то есть определяются не природой компонентов, а количеством растворенных частиц. К ним относятся: понижение упругости пара растворителя над раствором, осмотическое давление, повышение температуры кипения, понижение температуры замерзания раствора.
1) давление пара над раствором.
Пар, находящийся в равновесии с жидкостью называют насыщенным. Давление такого пара называют давлением или упругостью насыщенного пара чистого растворителя. При данной температуре давление насыщенного чистого растворителя остается постоянным – ТД характеристика растворителя. При повышенной температуре давление насыщенного пара над растворителем повышается по принципу Ле-Шателье. Если в летучий растворитель (вода, спирт) внести нелетучее растворенное вещество (сахароза), то концентрация растворителя уменьшается, следовательно, уменьшается число частиц растворителя, переходящих в газовую фазу и давление пара растворителя падает.
В 1886 году Рауль сформулировал закон:
Давление пара раствора, содержащего нелетучее растворенное вещество, прямо пропорционально молярной доле растворителя
Р – давление пара над раствором, Па
Кр – константа Рауля, Па
χ(Х1) – молярная доля растворителя Х1, которая равна:
χ(Х1) = n(X1) \ (n(X1) + n(X2))
 n(X1) и n(X2) – количество растворителя и растворенного вещества
n(X1) и n(X2) – количество растворителя и растворенного вещества
если χ(Х1) = 1 , то Кр = Р 0 (давление пара чистого растворителя) Р = Р 0 χ(Х1)
 χ(Х1) = 1 — χ(Х2) Р = Р 0 χ(1 — χ(Х2))
χ(Х1) = 1 — χ(Х2) Р = Р 0 χ(1 — χ(Х2))
χ(Х2) = (Р 0 – Р) \ Р 0
Р 0 – давление пара над чистым растворителем, Па
Р – давление пара растворителя над раствором нелетучего вещества, Па
Р 0 – Р – абсолютное понижение давления пара над раствором, Па
(Р 0 – Р) \ Р 0 – относительное понижение давления пара над раствором, Па
Закон Рауля справедлив только для идеальных растворов, то есть растворов, образование которых не сопровождается химическим взаимодействием и изменением объема.
25. повышение температуры кипения растворов. Формулы расчета. Эбулиометрическая константа, эбулиометрический метод определения молярной массы растворенного вещества.
Дата добавления: 2015-04-19 ; просмотров: 8878 . Нарушение авторских прав
studopedia.info
Вопрос. Растворы газов в жидкостях. Законы Генри, Генри-Дальтона, И.М. Сеченова
Растворение газов в жидкостях почти всегда сопровождается выделением теплоты(энтальпия дельта H
Закон Генри может быть записан в следующей форме:
где с – концентрация газа в насыщенном растворе, моль/л;
P(X) – давление газа X над раствором, Па;
Kr(X) – постоянная Генри для газа X.
Константа Генри зависит от природы газа, растворителя и температуры. Закон Генри справедлив лишь для сравнительно разбавленных растворов, при невысоких давлениях и отсутствии химического взаимодействия между молекулами растворяемого газа и растворителем.
Закон Генри является частным случаем общего закона Дальтона. Если речь идет о растворении не одного газообразного вещества, а смеси газов, то растворимость каждого компонента подчиняется закону Дальтона: растворимость каждого из компонентов газовой смеси при постоянной температуре пропорциональна парциальному давлению компонента над жидкостью и не зависит от общего давления смеси и индивидуальности других компонентов.
Иначе говоря, в случае растворения смеси газов в жидкости в математическое выражение закона Генри вместо подставляют парциальное давление р данного компонента.
Изучая растворимость газов в жидкостях в присутствии электролитов, русский врач-физиолог И. М. Сеченов (1829—1905) установил следующую закономерность (закон Сеченова): растворимость газов в жидкостях в присутствии электролитов понижается; происходит высаливание газов.
Робщ – общее давление газовой смеси;
х(Хi) – молярная доля i-ого компонента.
Изучая растворимость газов в жидкостях в присутствии электролитов, русский врач физиолог И. М. Сеченов (1829—1905) установил следующую закономерность (закон Сеченова): растворимость газов в жидкостях в присутствии электролитов понижается; происходит высаливание газов.
studopedia.org